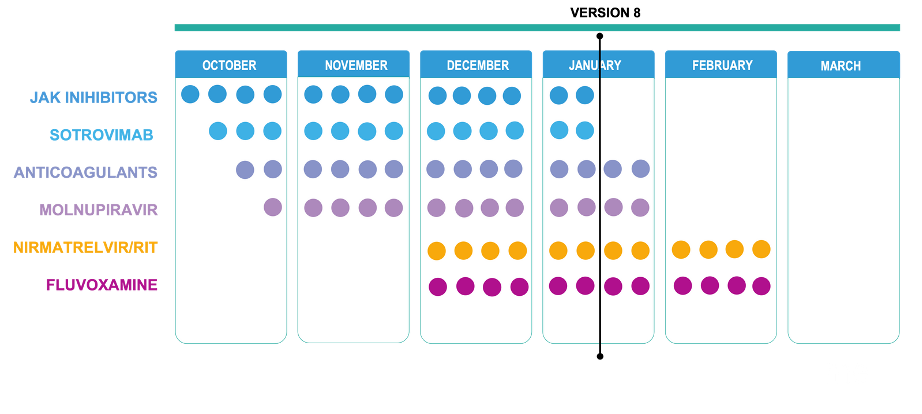
14 января 2022 года Всемирная организация здравоохранения (ВОЗ) представила восьмую обновленную версию руководства по терапии COVID-19. Оно содержит последние рекомендации Организации по использованию терапевтических средств при лечении COVID-19 и регулярно обновляется по мере появления новых данных. Обновления включают данные, появляющиеся в ходе оценки препаратов, а также указания на сроки прохождения стадий исследований.
Инфографика лекарств от COVID-19, находящихся на стадии оценки ВОЗ с контрольными точками в неделях.
Актуальная версия содержит три новых рекомендации по ингибиторам JAK (барицитиниб, руксолитиниб,тофацитиниб – три из по меньшей мере девяти ингибиторов JAK) и моноклональному антителу (сотровимаб).
Изменения были внесены по результатам трех РКИ по оценке барицитиниба с 2659 участниками, двух РКИ с 475 участниками по оценке руксолитиниба, одного РКИ с 289 участниками по оценке тофацитиниба, а также одного РКИ с 1057 участниками (которое было завершено до появления варианта омикрон) по оценке сотровимаба.
Новые рекомендации:
- настоятельная рекомендация по использованию барицитиниба в качестве альтернативы блокаторам рецепторов интерлейкина-6 (ИЛ-6) в сочетании с кортикостероидами у пациентов с тяжелой или критической формой COVID-19 – блокатор рецепторов ИЛ-6 и барицитиниб не следует назначать вместе, и их следует рассматривать как альтернативу. Выбор между использованием барицитиниба или блокатора рецепторов ИЛ-6 зависит от доступности, а также от клинических и контекстуальных факторов;
- условная рекомендация против использования руксолитиниба и тофацитиниба у пациентов с тяжелой или критической формой COVID-19 – клиницистам следует рассмотреть возможность использования этих препаратов только в том случае, если отсутствует доступ к барицитинибу и блокаторам рецепторов ИЛ-6 (тоцилизумаб или сарилумаб).
- условная рекомендация по применению сотровимаба у пациентов с нетяжелым течением COVID-19, условная для лиц с самым высоким риском госпитализации.
Два рекомендованных препарата также входили в список перспективных опций для лечения COVID-19 в рамках стратегии разработки новых методов лечения, опубликованной 22 октября Европейской комиссией (ЕК).
О терапевтических лекарствах:
Барицитиниб представляет собой лекарство, применяемое при активном ревматоидном артрите умеренной или тяжелой степени у взрослых пациентов с непереносимостью или отсутствием адекватного ответа на лечение одним или несколькими базисными противоревматическими ЛС (в виде монотерапии или в комбинированной терапии с метотрексатом). Барицитиниб относится к селективным и обратимым ингибиторам янус-киназы 1 и 2 (JAK1 и JAK2). Механизм действия этого класса препаратов при лечении короновирусной инфекции заключается в ингибировании внутриклеточной передачи сигналов за счет многофакторного воздействия на передачу сигналов цитокинов. Как следствие, они нарушают многие клеточные реакции, включая противовирусные реакции, экспрессию ангиотензинпревращающего фермента 2 (AПФ2), функцию и дифференцировку Т-клеток, а также активацию макрофагов.
В феврале 2017 года барицитиниб был одобрен для использования в ЕС в качестве терапии второй линии при умеренном и тяжелом активном ревматоидном артрите у взрослых, отдельно или в комбинации.
29 апреля 2021 года EMA приступило к рассмотрению заявки на расширение использования препарата Olumiant (барицитиниб) для терапии COVID-19 у госпитализированных пациентов в возрасте от 10 лет, которым требуется дополнительный кислород.
31 мая 2018 г. FDA одобрило барицитиниб для лечения взрослых пациентов с умеренно или сильно активным ревматоидным артритом.
В ноябре 2020 года FDA выдало разрешение на экстренное использование (EUA) комбинации барицитиниба с ремдесивиром для лечения подозреваемого или лабораторно подтвержденного COVID-19 у госпитализированных пациентов в возрасте от двух лет и старше, нуждающихся в дополнительном кислороде, инвазивной механической вентиляции легких или экстракорпоральной мембранной оксигенации (ЭКМО).
В июле 2021 года FDA пересмотрело EUA для барицитиниба, разрешив его отдельное применение для лечения COVID-19 у госпитализированных людей в возрасте от двух лет и старше, которым требуется дополнительный кислород, неинвазивная или инвазивная механическая вентиляция лёгких или экстракорпоральная мембранная оксигенация (ЭКМО). Согласно пересмотренной версии EUA, барицитиниб больше не требуется вводить с ремдесивиром.
Рекомендация ВОЗ для барицитиниба у пациентов с тяжелым или критическим заболеванием основана на данных о преимуществах в отношении смертности и продолжительности ИВЛ, а также продолжительности пребывания в стационаре, при отсутствии увеличения побочных эффектов, приводящих к прекращению приема препарата. Барицитиниб и блокаторы рецепторов ИЛ-6 (тоцилизумаб или сарилумаб) являются альтернативами. Подробнее данные представлены в соответствующем разделе руководства.
В РФ барицитиниб зарегистрирован под ТН «Олумиант», входит в перечень в ЖНВЛП.
В актуальных (14 версия) Методических Рекомендациях «Профилактика, диагностика и лечение короновирусной инфекции (COVID-19)» барицитиниб присутствует в перечне препаратов упреждающей противовоспалительной терапии COVID-19 у взрослых и входит в рекомендованные схемы лечения в условиях стационара.
На территории России локализация осуществлена на площадке ОАО «Фармстандарт-УфаВИТА». Предельная отпускная цена без НДС составляет 20 129,2 рубля за упаковку 14 таблеток по 4 мг. Согласно рекомендациям, курс составляет от 7 до 14 дней с суточной дозировкой 4 мг.
Сотровимаб (VIR-7831; GSK4182136) представляет собой человеческое моноклональное антитело, которое связывается с консервативным эпитопом спайкового белка SARS-CoV-2, предотвращая проникновение вируса в клетки. Препарат разрабатывается компаниями GlaxoSmithKline и Vir Biotechnology, Inc. Механизм действия сотровимаба заключается в прикреплении к белку-шипу SARS-CoV-2 и предотвращении соединения шипа с клеткой. Сотровимаб (на тот момент известный как VIR-7831) был получен из родительского антитела (S309), впервые выделенного в 2003 году из В-клеток памяти, взятых у человека, вылечившегося от тяжелого острого респираторного синдрома (SARS). Родительское антитело S309 было нацелено на гликопротеин шипа (S-белок), который используется вирусом SARS-Cov-2 для проникновения в клетки и является основной мишенью для нейтрализующих антител.
Сотровимаб проходит следующие клинические испытания: «COMET-ICE», «COMET-PEAK», «ACTIV-3-TICO» и «BLAZE-4».
Основное исследование COMET-ICE – рандомизированное двойное слепое плацебо-контролируемое исследование для оценки безопасности и эффективности сотровимаба у взрослых с подтвержденным COVID-19 (легкое, раннее заболевание с симптомами менее 5 дней) из группы риска. Оценивается риск прогрессирования заболевания.
Запланированный промежуточный анализ этого исследования показал, что сотровимаб снижает риск длительной госпитализации (на срок более 24 часов) или смерти на 85% по сравнению с плацебо. В целом 1% пациентов, получавших сотровимаб, умерли или нуждались в госпитализации на срок более 24 часов по сравнению с 7% пациентов, получавших плацебо.
21 мая 2021 года Комитет по лекарственным средствам человека (CHMP) Европейского агентства по лекарственным средствам (EMA) завершил обзор использования сотровимаба для лечения COVID-19. В нем сделан вывод о том, что сотровимаб может использоваться для лечения подтвержденного COVID-19 у взрослых и подростков (в возрасте от 12 лет и старше и с массой тела не менее 40 кг), которым не требуется дополнительный кислород и которые подвержены риску прогрессирования в тяжелую форму COVID-19. 17 декабря 2021 года было выдано разрешение на использование препарата для раннего лечения COVID-19.
26 мая 2021 года GSK сообщала в пресс-релизе, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдало разрешение на экстренное использование (EUA) сотровимаба для лечения COVID-19 легкой и средней степени тяжести у людей в возрасте от 12 лет и старше с массой тела не менее 40 кг с положительными результатами тестирования на вирус SARS-CoV-2, имеющих высокий риск прогрессирования до тяжелой формы COVID-19, включая госпитализацию или смерть. В США данный препарат на сегодняшний день не доступен для приобретения и закупается только в рамках правительственных контрактов, последнее соглашение из которых было заключено 11.01.2022г.
Рекомендация ВОЗ по применению моноклонального антитела сотровимаб у пациентов с нетяжелым течением болезни основана на данных о существенном снижении риска госпитализации и незначительных преимуществах у пациентов с более низким риском. Однако, как упоминалось, оценка происходила до появления штамма Омикрон, в связи с чем ВОЗ не обладает достаточными данными об эффективности для новых вариантов, что, вероятно, может повлиять на будущие рекомендации. Для моноклональных антител, используемых в качестве отдельных агентов, описано быстрое появление резистентности у пациентов, но до сих пор не было подобных клинических заключений для сотровимаба: «резистентность к сотровимабу может возникнуть в экспериментальных условиях, но существует неопределенность в отношении скорости, с которой это произойдет у пациентов, и конечных клинических последствий». При этом по представленным GSK в начале декабря 2021 года данным доклинических исследований демонстрируется, что сотровимаб сохраняет активность против полной комбинации мутаций в шиповидном белке варианта Omicron SARS-CoV-2.
В РФ сотровимаб не зарегистрирован.
В актуальных (14 версия) Методических Рекомендациях «Профилактика, диагностика и лечение короновирусной инфекции (COVID-19)» сотровимаб присутствует в списке возможных к назначению лекарственных средств для лечения COVID-19 у взрослых.
Из моноклональных антител (МКА) с вируснейтрализующим действием в отношении SARS-CoV-2 в настоящее время рекомендации предполагают использование однокомпонентные (сотровимаб, регданвимаб), а также комбинированные (бамланивимаб+этесевимаб; касиривимаб+имдевимаб) препараты. Однако данные препараты не зарегистрированы в Российской Федерации, в связи с чем их назначение возможно только при наличии решения врачебной комиссии и разрешения на временное обращение (постановление Правительства Российской Федерации от 3 апреля 2020 г. № 441).


Оставить комментарий